

Rappel
Quelle est la forme hydratée de l’ion H+?
Motivation
H2SO4 et NaOH sont de quels types de composés ?
Annonce du sujet
Qu'allons-nous voir aujourd'hui?
Analyse
Qu’est-ce qu’un acide d’Arrhenius ?
Qu’est-ce qu’un acide de Bronsted Conwy ?
Qu’est-ce que la théorie de Lewis ?
Qu’est-ce qu’un acide selon Arrhenius ?
H3O+
H2SO4 : acide
NaOH : base
Aujourd'hui, nous allons étudier théorie acide-base.
Théorie d’Arrhenius Ostwald
Acide
Définition :Un acide est une substance qui en solution aqueuse libère les ions H+ ou portions.
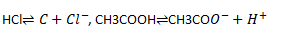
Base
Définition: est une substance qui libère un ou plusieurs ions OH- en solution aqueuse.
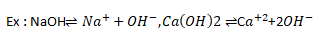
Insuffisance de cette théorie
Le gaz NH3 et les arènes sont des bases mais n’ont pas de même groupement OH-
Le proton H+, qui est un acide, ne répond pas à cette définition.
-Le proton H+est toujours hydraté en solution aqueuse en donnant l’ion H3O+
Théorie des protons ou Bronsted Conwy
Cette théorie repose sur l’échange de l’ion H+.
Acide
Un acide est un donneur de protons (même qu’Arrhenius)
Base
Une base est une substance qui, en solution capte les protons (accepteurs de protons).
Selon Bronsted, les acides et les bases peuvent êtres des molécules neutres ou des ions.
Ex :
1) CH3COOH⇌CH3COO-+H+ (acide)
2) HCl⇌H++Cl- (acide)
3) H2O⇌H++OH- (base)
4) NH3+H+⇌NH4+
5) H2O+H+ ⇌ H3O+
6)OH-+H+⇌ H2O
Théorie de Lewis
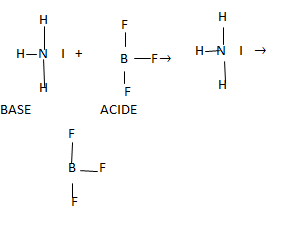
Acide
Un acide est un accepteur de doublets électroniques ou de paires d’électrons.
Base
C'est un donneur de doublets électroniques.
C’est une substance qui libère le H+ en solution aqueuse.