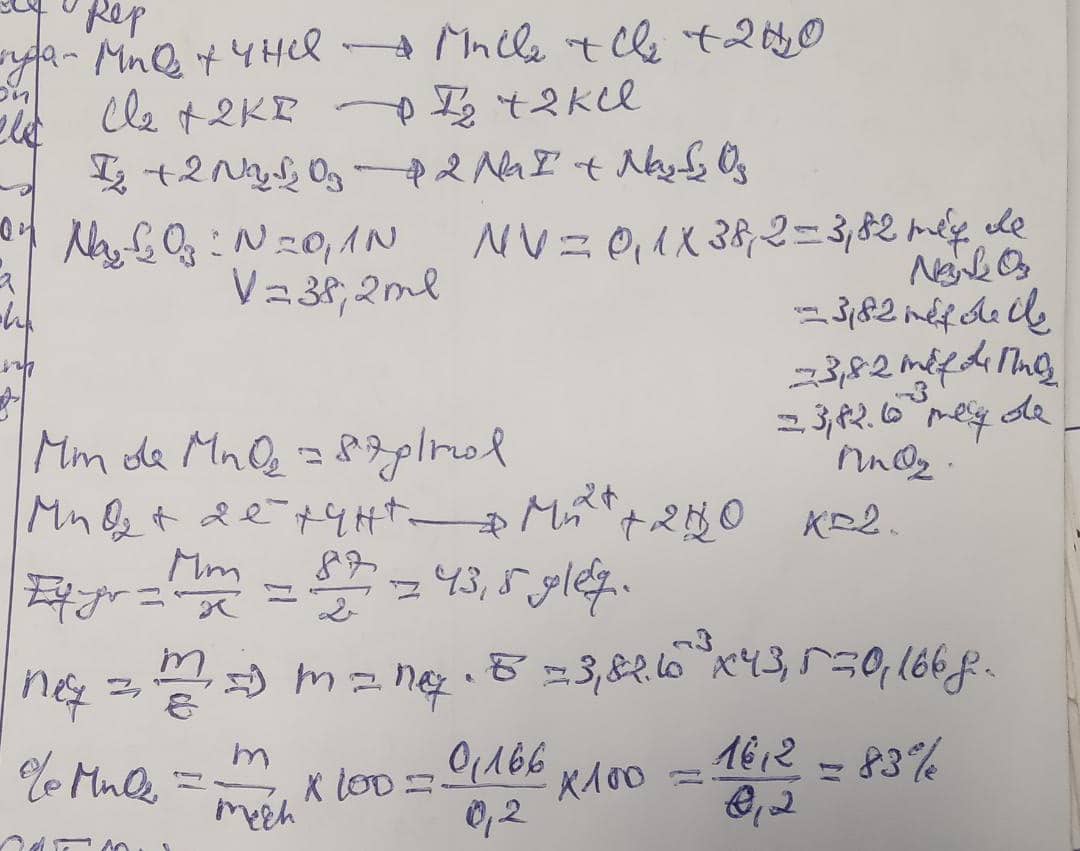a) Révision: Pour neutraliser complétement 100ml d'une solution de HCL, il faut 2,16 g de corbonate de collium par la nosmalité de l'acide était: 1. 4,32N, 2. 1,08N, 3. 0,432N , 4. 0,216N, 5. 0,108N.
b) Motivation: Quelle est la méthode qui est basée sur le titrage en utilisant le pouvoir axglent?
c) Annonce du sujet
Qu'est-ce que nous allons étudier aujourd'hui?
Exemple: on dissent 0,5g d'un échantillon de fer impur dans 35ml d'acide sulfurique pour former le Fe2+. On utilise 50ml d'une solution KmnO4 , 0,02M pour voir la pureté de l'échantillon.
Quels sont les principes d'iooloretrie et iodimetrice ?
Exemple 2: on troite 0,2g de pyrolusite (diolyde de manganèse ) par 25 ml d'une solution de Hcl à 37% et on recueille le chlore qui se degage dans une solution de KI à 2%. on titre l'iode liberé par la réaction au moyen d'une solution de thiosulfate do sodium 0,1N . On utilise à cet effet 38,2ml.Quel
SYNTHESE
Cfr analyse
b) solution titre de Na2S2O3 (thiosulfation do sodim)
Le Na2S2O3 étant solide qu'on retrouve le plus souvent sans forme de inistaux de thiosulfate de sodium peutatyodraté (Na2S2O3, 5H2O)
c) solution titrée de KI à 2%
Dans ce cas, il suffit de dissoine 2g de KI dans 98 ml d'eau distillée.
4. Indicateur de fin de titrage on utilise l'amidon sans forme d'empreis comme indicateur specifique. la fin de titrage est detectée par l'apparition d'une coloration, l'iode moleculaire colore l'amidon en bleu interse au violacé.
5. Titrage d'iodometrique et iodimetrique
a) Titrage direct : on dose disrectement le diode par une solution titrée de Na2S2O3
I2 + 2Na2S2O3 ----> 2 NaI + Na2 S4O6
b) Titrage indirect: On dose un axydent qu'on fait réagir avec une solution de KI à 2%
6. Avantage et Inconvénient
6.1. Avantage
-L'iode présente un système reversible et selutif : I2 + 2e> < 2I : Il permet de soser aussi bien oxydent que les reducteurs.
-le patentiel standand de son système est independant du pH DU MILIEU jusqu'au : pH = 9.
- La technique du dosage en retour peut déterminer avec précision le P.E
b) Inconvénient :
-L'iode se sublime facilement: on ne peut pa l'utiliser comme etalon primaire.
- l'indicateur utilisé l'amidon est décomposé par le bacteries et se coagule avec la chaleur.
-En milieu alcolin (pH >9) apparait par dismutation, l'ion hypoiodite.
I2 + 2OH ----> IO + I H2O
-La réaction entre l'iode et la plus part des reducteurs évolue lentement à la fin de titrage.