

a) Révision: A une solution de 300ml d'acide Benzoique 5.10-N (C6H5COOH : pKa = 4,2) , on ajoute 500ml de soude consiste que 10-N Quelle est la valeur du pH?
b) Motivation:
Comment appel-t-on une réaction dont l'oxyd action et le reduction se deroule au même moment
c) Annonce du sujet:
Nous allons étudier quoi aujourd'hui?
II. Analyse
Quel est l'EO des ions suivants ?
a) Ca2+ b) O2- c) Cl- d) Al3+
Quel est l'EO des ions suivants:
a) de s dans HSO4-
b) de Cr dans Cr2 (SO4)3
Trouvez l'E.O de : a) H dans H2. b) Na
Déterminer l'EO de : a) P dans PH3; b) Cl dans Ncl3
Calculez l'E.O de: Fe dans Fe2 (SO4)3; b) Cr dans Cr (SO4)3; c) S dans S2O3-2
Qu'entendez-vous par: 1) OXYDANT
2) Reducteur
3) Forme reduite
4) Forme oxydée.
III. Synthèse
cfr analyse
# 2) Cas DE =/ 0
-On pose E.O de H= +1 sauf dans le cas des Hyonnes où E.O de H=-1.
- On pose E.O de 0 =-2 sauf dans le cas des phoxydes où E.O de 0 =-1
Règle générale: la somme algebrique des étage d'oxydation de tous les atomes dans une molécule est égale à 2ero.
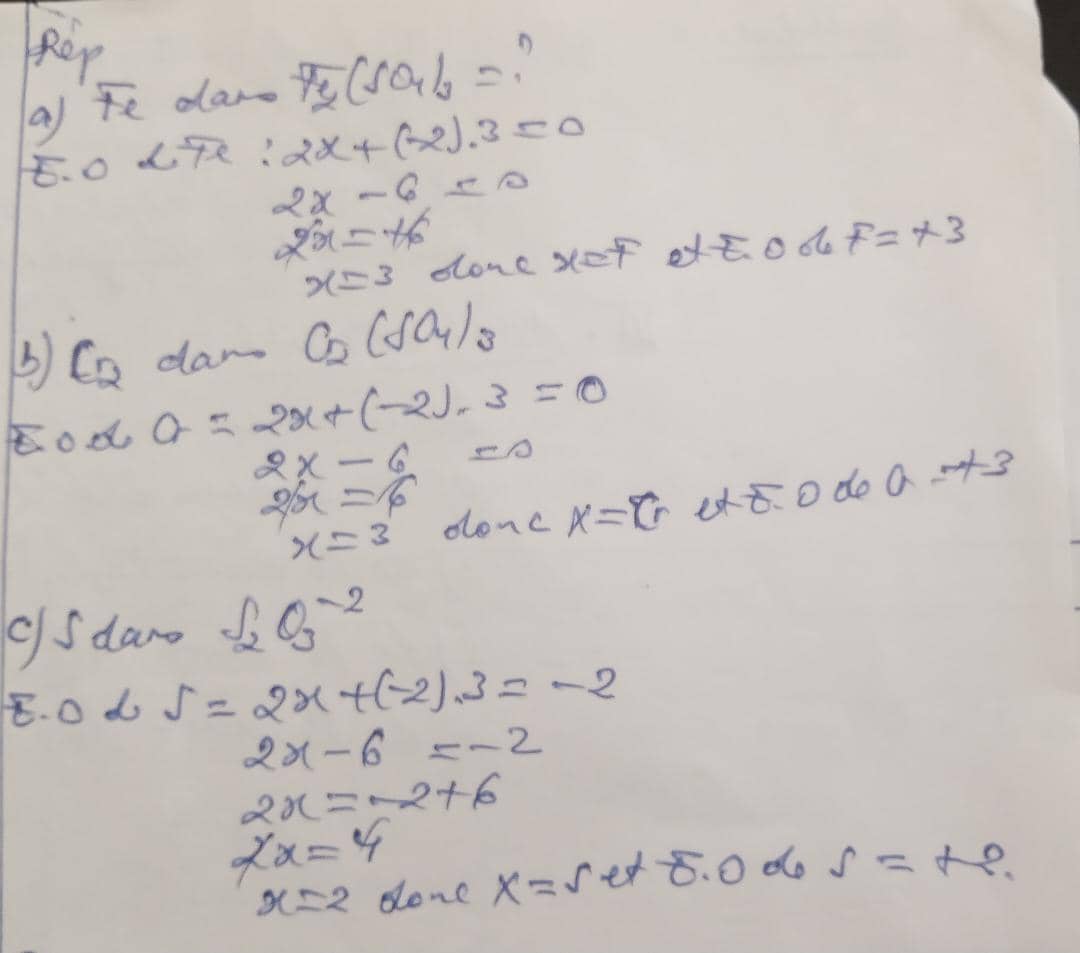
Quelques définitions
1. OXYDANT: c'est une substance ou un corps oxyde capable de descentre d'E.O, capable de fixer les électrons , fixer l'Hydrogene et de perdre l'oxygère.
2. REDUCTEUR: Une substance reduite capable de monter l'E.O, perdre les électrons et l'Hyohgene et de fixer l'oxygène.
3. Forme oxydee: C'est un corps qui a liberer les élatrons qui est monté d'EO qui perdu l'Hydrogène et qui à capté l'oxygène.
4. Forme reduite : c'est un corps qui à liberé les électons descendu d'EO perdu l'oxygène et qui a capte l'Hydrogène.
5. OXYDATION:: c'est une montée d' EO par perte d'electron

-EO d'un ion ou d'un atome dans une molécule est nombre d'électrons perdu au gagné à l'atome a partir de sin état fondamental.
-L'EO de l'oxygène (0) est égal à -2, mais ssauf dans le cas des peroxydes est égal "="