

1. VERIFICATION: des connaissances précédente:
définissez: a) un atome
b) une molécule
c) un ion
2. MOTIVATION (découverte)
Comment peut-on connaître le poids moléculaire des composés suivant:
H2SO4 et NaOH?
Organisation des classes et consignes
Regrouper les élèves en groupe de 5
Question de récapitulation
Qu'est-ce qu'une masse atomique relative?
Qu'est-ce qu'une masse moléculaire?
Ex: déterminez la Mr de:
a) H2O
b) Na2SO2
c) CNH4/2 SO2
Qu'entendez vous par NA?
Définissez la masse moléculaire
Ex: calculez la masse molaire de calcule des substances suivants:
a) Na2SO4
b) CR2 CSO4/3
c) H2O
Vérification des acquis
Calculez la masse moléculaire et la masse de composés suivants:
1) KMnO4
2) FeSO4
3) Na2S2O3.SH2O
a) Un atome c'est la plus petite partie d'un corps simple pouvant se combiner chimiquement avec un autre atome
b) une molécule c'est une combinaison de deux ou plusieurs atomes
c) un ion: c'est un atome ou groupe d'atome qui portent de charge négative ou positif
2) Compétence à la situation
En utilisant les données et expressions quantitatives dans le tp.
Activités dans le tableau spécifique.
DONNEES ET EXPRESSIONS QUANTITAVES
Participation des élèves à la production de la synthèse
1. DONNES ET EXPRESSION QUANTITATIVE
Masse atomique relative(Ar)
C'est le rapport entre la masse d'un atome d'un élément et la masse de la 12em partie d'un atome de carbone -12
Exemple: -Ar de H=1 U.m a
-Ar de O = 16 Um.a
-Ar de Mp =
-Ar de Na= 23 U.ma
U.m.a: unité de masse atomique
Masse moléculaire relative(Mr)
C'est le rapport entre la masse d'une molécule d'une substance et la masse de la 12em partie d'un atome de carbone -12
Elle exprime aussi en u.m.a
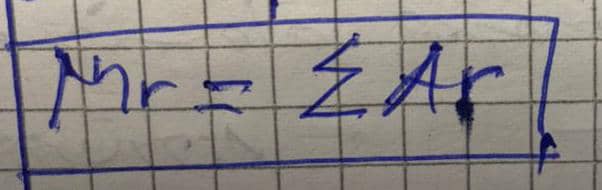
a) Mr de H2O =(2x1)+16=2+16=18uma
b) Mr de Na2SO4= (2x23)+32+(4x16)
=46+32+64
=142 uma
c) Mr de (NH4/2 SO4
Mr = (2+14) + (8+1) + 32+(4x16)
= 28+8+32+64
=132 u.m.a
Nombre d'avogache(NA)
C'est le nombre d'atome d'hydrogène.
Le nombre d'avogadre vaut: NA= 6,021023
MOLE
C'est la quantité des matières qui renferme NA particules (atomes, molécule,ions)
NA= 6,021023 particules/mol
Masse molaire (Mm)
C'est la masse d'une mole d'une substance
Elle s'exprime en g/mol
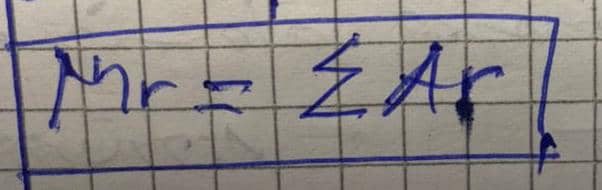
a) Mm de Na2SO2=(2x23)+32+(4x16)
=46+32+64
=142g/mol
b) Mm de U2(SO4)3=(2x52)+(3x32)+(12x16
=104+96+192
=392 g/mol
1.Mr de KMnO4= 39+55+(4x16)
=39+55+64
=158 u.m.a
Mm de KMnO4= 39+55+(4x16)
=39+55+64
158 g/mol
2.Fe SO4/Mr de FeSO4=56+32+64
=152 u.m.a
Mm de FeSO4= 56+32+64=152g/mol
3. Mr de Na2 S2 O3.SH2O
Mr=(2x23+(2x32)+(3x16)+(5x18)
=46+64+48+90
=248 uma
Mm= (2x23)+(2x32)+(3x16)+(5x18)
=46+64+48+90
=248 g/mol