Révision: Lorsque on titre 0,500g d'un échantillon de Ba(OH)2, on utilise 30ml d'une solution de Hcl 0,137N. le pourcentage de Ba (OH)2 contenu dans cet échantillon est égal à?
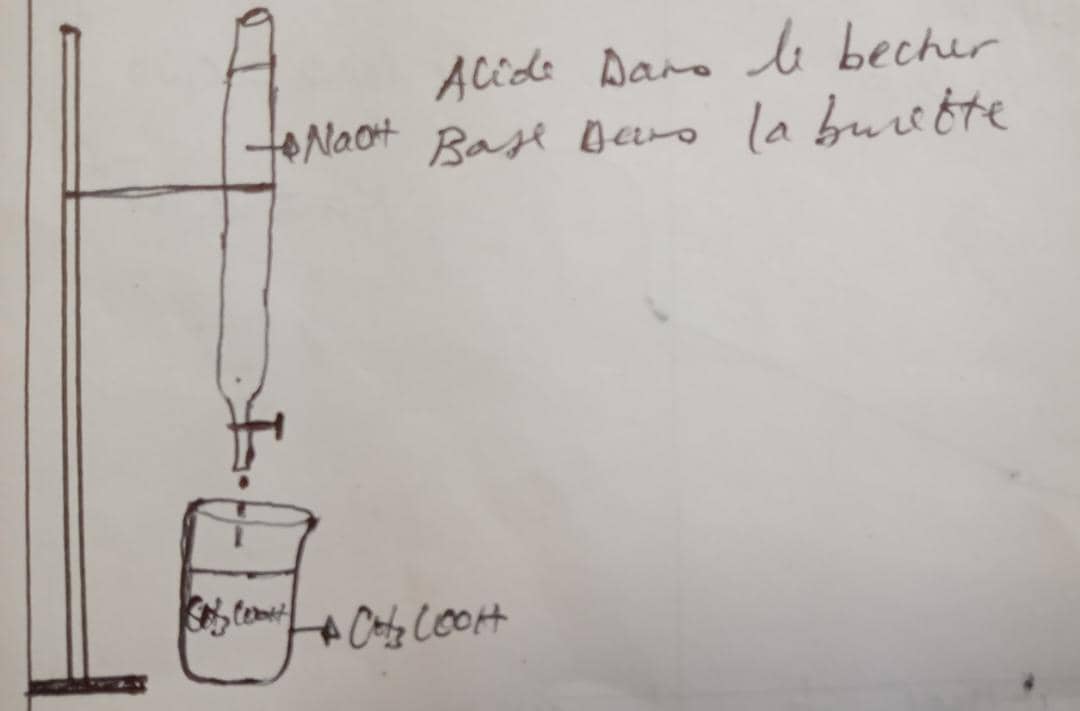
b) Motivation: Comment appel-t-on cette réaction: CH3COOH + NaOH ----> CH3COONa +H2O?
c) Annonce :
Qu'est-ce que nous allons étudier aujourd'hui?
II. Analyse
Exemple:
1) On neutralise progressivement une solution d'acide éthamoigue par une solution d'hyohoxyde de soud on mesure le pH après chaque addition de NaOH et on obtient la courbe de neutralisation ci-dessus. De l'analyse de le courbe , on peut déduire que la constante d'ionsation Ka de l'acide. Ethanoique est :
III. SYNTHESE
Cfr analyse
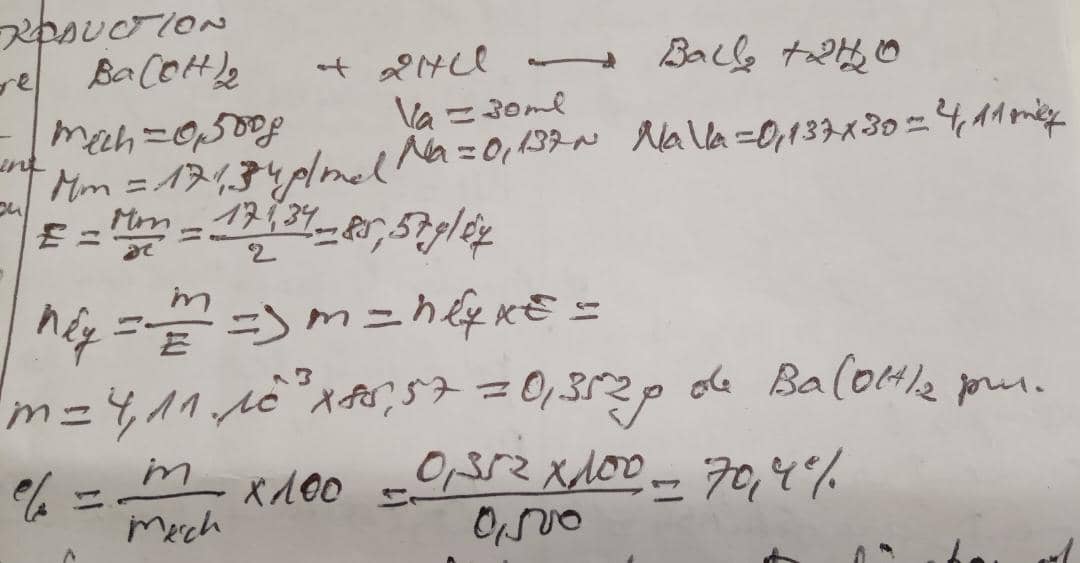
C'est une réaction de neutralisation d'un acide faible par une base forte
Aujourd'hui nous allons parlé de neutralisation d'un acide
3.5. COURBES DE NEUTRALISATION D'UN ACIDE TAIBLE PAR UNE BASE FORTE